がん細胞を死滅させる不織布
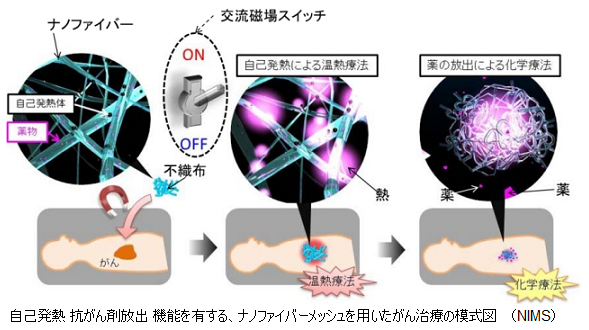
患部に貼ることでがん細胞を死滅させる効果がある不織布を、物質・材料研究機構の荏原充宏主任研究員らが開発した。不織布の超微細な繊維(ナノファイバー)には、交流磁場をかけることで発熱する微粒子(磁性ナノ粒子)、および抗がん剤が含まれ、発熱したナノファイバーが縮むことで抗がん剤を放出する。がん細胞が熱に弱いことを利用した温熱療法と抗がん剤を使った化学療法を同時に行う“ダブル療法”として注目される。
研究者らは、皮膚がんの一種である悪性黒色腫の細胞を入れた皿に不織布を乗せ、培養3日目に磁場を5分間かけたところ、翌日にはがん細胞が7割近く死滅した。さらに5分間磁場をかけると、翌日(培養5日目)には8割近くのがん細胞が死滅した。磁性ナノ粒子だけを入れた不織布や抗がん剤だけを投与した場合に比べ、より多くのがん細胞が死滅した。これらの処理をしない場合は、がん細胞が6割近く増加した。また、がん細胞を染色することで、磁性ナノ粒子と抗がん剤を含む不織布を乗せて磁場をかけた時に、効果的にがん細胞を死滅させることも確認された。
今後は、手術後の再発防止への使用や、抗がん剤や磁性ナノ粒子以外の薬物との併用、さらには体内に残せるような生分解性の性質を加えるなど、より機能的な不織布の開発が考えられるという。
研究論文”A Smart Hyperthermia Nanofiber with Switchable Drug Release for Inducing Cancer Apoptosis”は、科学雑誌『Advanced Functional Materials』のオンライン速報版で14日に掲載された。(サイエンスポータル 2013年6月19日)
貼り付ける新素材…熱と薬で、がんダブル攻撃
がんの患部に貼り付け、熱と抗がん剤のダブル攻撃で治療できる可能性のある素材を開発したと、物質・材料研究機構(茨城県つくば市)が14日、材料科学の専門誌電子版に発表した。
体の組織は、温度が高くなると血流を増やして放熱する。がん組織の血管はその機能が不十分で、正常組織より熱に弱い。加熱しながら抗がん剤などを使うと、効果が高まるとされる。
荏原充宏・同機構主任研究員らは、温度が上がると縮む性質のある高分子に、磁場をかけると温度が上がる物質と抗がん剤を加えて化学反応させ、繊維状に加工した。この繊維に磁場をかけると発熱し、収縮して抗がん剤が外へしみ出す。
培養した皮膚がんの細胞の上にこの繊維を置き、磁場を2回(各5分間)かけて45度まで熱したところ、がん細胞は5日後に27%まで減少した。抗がん剤だけを加えた時は40%までしか減らず、何もしないと2.4倍に増殖した。
研究チームは、皮膚がんのほか、食道など様々な臓器の粘膜に発生する「扁平(へんぺい)上皮がん」の治療に応用できると期待している。(読売新聞 6月15日)
NIMS、がんの温熱療法と化学療法を同時に行えるナノ構造のメッシュを開発
注目される温熱治療
物質・材料研究機構(NIMS)は6月12日、がんの「温熱療法(ハイパーサーミア)」と化学療法(抗がん剤治療)を同時に実現させることが可能な「ナノファイバーメッシュ」を新たに開発することに成功し、上皮性のがん細胞を効率的に「アポトーシス(プログラム細胞死)」させることに成功したと発表した。
成果は、NIMS 国際ナノアーキテクトニクス研究拠点 生体機能材料ユニットの荏原充宏MANA研究者らの研究チームによるもの。研究の詳細な内容は、日本時間6月14日付けで科学誌「Advanced Functional Materials」オンライン速報版に掲載された。
上皮性の悪性腫瘍の1つである扁平上皮がんは多くの組織で認められるがんだ。例えば、食道がんの90%以上、子宮頚部がんの80%以上、肺がんの30%以上は扁平上皮がんが占めているといわれている。治療方法は、がんの進行度によって手術、放射線療法、化学療法が3本柱となっているが、これらに加え、近年高い注目を集めているのが温熱療法だ。
温熱療法はがん細胞が正常な細胞と比べ熱に弱いことを利用して死滅させる仕組みで、抗がん剤を併用するとその効果が向上すること、疼痛緩和などの効用もわかっている。しかし、実際に温熱療法と抗がん剤投与を併用するには、独立した2つの治療法を別々に行わなければならず、これまで、同じ場所で同じタイミングで精密に制御することが困難なことが課題となっていた。
抗ガン剤とナノファイバーメッシュの組み合わせ
今回開発されたナノファイバーメッシュは、温度応答性高分子、磁性ナノ粒子、抗がん剤を組み合わせたハイブリッド材料が用いられており、患部に直接貼れるメッシュ状の材料である。温度応答性高分子を電解紡糸法によってナノファイバー状に加工し、不織布を作製。この際、ファイバー内には磁性ナノ粒子が包含されているため、交流磁場の印加によって内部の磁性ナノ粒子を自己発熱させ、ファイバーを加熱することに成功した。
また、自己発熱で生じた熱に応答して、温度応答性高分子が脱水和するため、内部の水と共に内部の抗がん剤を外部に放出させることができるというわけだ。これにより、上皮性悪性腫瘍に対して温熱療法と化学療法を同時に行えるようになったのである。
これまで開発されてきた磁性ナノ粒子を用いた磁気温熱療法の場合は、磁性ナノ粒子をそのまま体内に投与するため、患部でのハンドリングが難しい上に、磁性ナノ粒子自体の安全性が懸念されていたが、今回のナノファイバーメッシュはハンドリングしやすく、内視鏡手術などでも使用することが可能だ。
また、ファイバー内の磁性粒子は安定に存在するため体内への拡散も抑えられ、磁性粒子を直接投与する方法と比べて安全性は高いと考えられる。また、ナノファイバーメッシュは、自己発熱体である磁性ナノ粒子を含んでいるため、交流磁場をかけることでファイバーを加熱でき、その生じた熱に応答して温度応答性高分子が収縮することで、内部の抗がん剤を外部に放出させる仕組みを持つ。
実際にヒトメラノーマ細胞株を用いてナノファイバーメッシュの抗がん活性が調べられたところ、交流磁場の印加によってがん細胞増殖が大幅に抑制できることが明らかとなった。磁性粒子入りファイバーおよび抗がん剤投与をそれぞれ単独に行った場合と比べ、両方を含有するナノファイバーメッシュを細胞に添加した時にもっとも高い殺傷能力(70%)が確かめられた。
がん細胞を効果的にアポトーシスさせる
また、初期および後期のアポトーシスを調べるため、「Annexin V」および「TUNEL染色」をそれぞれ行った結果、抗がん剤と磁性粒子を含むナノファイバーメッシュを加えた際に蛍光が見られた。これはがん細胞がアポトーシスしていることを示している。つまり、ナノファイバーメッシュをがん細胞上に乗せ、交流磁場を加えることでがん細胞を効果的にアポトーシスさせることができたというわけだ。つまり、交流磁場をかけるとがん細胞のアポトーシス誘導をON-OFF制御可能であることが明らかとなったのである。その点から、病気の治療の時空間制御(任意のタイミング・場所での薬の投与など)が求められている21世紀において、次世代医療材料の開発の大きな前進となるという。
治療技術の進歩に伴って、最近ではがん細胞が粘膜内だけにとどまる場合は、内視鏡による治療などが行えるようになってきている。すなわち、ハンドリングがしやすく、かつ、それ自体が抗がん活性を有するメッシュ状の材料の開発は、がん患者の生存率の向上のみならず、低侵襲治療法の提供にもつながると考えられるというわけだ。
例えばナノファイバーメッシュの想定される治療法としては、内視鏡でがんを取り除いた後、患部にこのメッシュを直接貼り、外から任意のタイミングで磁場をかけることで、がんを効率的に消滅させることが考えられるという。またナノファイバーメッシュは、抗がん剤や磁性粒子以外にもさまざまな物質の内包が容易に行えるため、生体透過性の高い近赤外応答材料や、そのほかの薬物との併用、さらには生分解性などを付与することでより機能的なナノファイバーメッシュの開発につながると考えられるとしている。
参考HP マイナビニュース:がんの温熱治療と化学療法を同時に行えるナノメッシュ
 | 京都府立医大のがん「温熱・免疫療法」 |
| クリエーター情報なし | |
| PHP研究所 |
 | 図解 がん治療を受ける前に知っておきたい55のこと |
| クリエーター情報なし | |
| エクスナレッジ |
��潟�<�潟��